Миелодисплазия поясничного отдела мкб 10

Причины
Первичный (идиоптический) тип — 80-90 % случаев, вторичный(вследствие предшествующей химиотерапии и факторов) — 10-20 %. Большинство (80 %) случаев МДС являются первичными — идиопатическими или de novo (лат. — вновь появившийся, новый). Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС.
10-20 % случаев МДС возникают вследствие предшествующей химиотерапии по поводу других новообразований. К препаратам, обладающим доказанной способностью повреждать геном с последующим развитием МДС, относятся алкилирующие агенты (циклофосфан), ингибиторы, топоизомеразы — противоопухолевые агенты растительного происхождения (топотекан, иринотекан и ), антрациклины (доксорубицин) и подофиллотоксины (этопозид).
https://www.youtube.com/watch?v=ytcreatorsen-GB
К МДС также могут приводить радиотерапия и контакт с токсическими материалами. Факторы риска, первичный МДС: • Контакт с токсинами (бензин, органические растворители, пестициды). • Радиация. • Курение. • Врожденные и наследственные заболевания. • Пожилой возраст. Факторы риска, вторичный МДС: Предшествующая химиотерапия онкологического заболевания или после ТКМ.
Лечение
Не все пациенты с МДС нуждаются в терапии. Пациенты без анемического, геморрагического синдрома, инфекционных осложнений могут наблюдаться и не получать лечения (тактика «watch and wait»). Выбор терапевтической тактики во многом определятся возрастом пациента, соматическим статусом, степенью риска по шкале IPSS, WPSS, наличием совместимого донора.
Можно выделить следующие направления терапии МДС: • Сопроводительная терапия включает в себя переливание различных гемокомпонентов (эритроцитарной массы, тромбоконцентрата), терапию эритропоэтином, тромбопоэтином. У больных часто получающих гемотрансфузии развивается перегрузка организма железом. Железо обладает токсическим действием на различные ткани и органы, в первую очередь сердце, печень, поэтому такие пациенты должны получать препараты, связывающие железо — хелаторы (десферал, эксиджад).
• Иммуносупрессивная терапия наиболее эффективна у пациентов с гипоклеточным костным мозгом, нормальным кариотипом и наличием HLA-DR15. Леналидомид, обладающий иммуномодулирующим и антиангиогенным действием, показал свою эффективность у трети пациентов с рефрактерной анемией (согласно критериям ВОЗ) и низким риском (по IPSS), а также у больных с 5q- синдромом.
Эффективность лечения в данном случае весьма высока; 95 % больных достигают цитогенетической ремиссии. • Аллогенная трансплантация гемопоэтических стволовых клеток от совместимых доноров является методом выбора у пациентов с миелодиспластическим синдромом. Пациентам с МДС моложе 65 лет, с хорошим соматическим статусом, при наличии HLA-совместимого донора показано проведение аллогенной трансплантации костного мозга, так как трансплантация является потенциально радикальным методом лечения МДС.
• Химиотерапия. • Цитарабин, низкие дозы. Широко используются в России, да и во всей Европе, для лечения пациентов с МДС и ОМЛ, которым не подходит терапия методом ТКМ или применение интенсивной химиотерапии. Мнения исследователей относительно целесообразности использования низкоинтенсивной терапии расходятся.
Bowen D считает, что нет оснований рекомендовать её рутинное использование при МДС: было выполнено 3 рандомизированных крупных исследования (141 пац. ), которые показали, что применение низких доз цитарабина не увеличивает продолжительность жизни пациентов с МДС. Вместе с тем, в более позднем исследовании у пациентов с ОМЛ и МДС высокого риска было показано, что продолжительность жизни у больных, у которых применялся LDAC более, чем в 1 цикле, выше, чем при поддерживающей терапии.
Таким образом, необходимость в низкоинтенсивной терапии с доказанной эффективностью и лучшей переносимостью, чем LDAC, которая будет способствовать увеличению выживаемости пациентов с МДС высокого риска, остается актуальной. • Высокодозная химиотерапия используется у больных с РАИБ с гипер- и нормоклеточным костным, при трансформации в ОМЛ.
Пятилетняя выживаемость составляет около 18 %. • Гипометилирующие препараты. Новые многообещающие терапевтические подходы, широко обсуждающиеся в последнее время, по поводу которых проводятся многочисленные клинические исследования, возникли в результате глубокого изучения биологии МДС. Среди них следует отметить ингибиторы метилирования ДНК (5-азацитидин, децитабин) и иммуномодулятор — леналидомид.
5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение.
https://www.youtube.com/watch?v=https:accounts.google.comServiceLogin
Азацитидин, встраиваясь в РНК молекулу, тем самым понижает её количество в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы. На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое, в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартным лечением (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость.
Источник
Связанные заболевания и их лечение
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Причины
- Прогноз
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Миелодиспластический синдром.
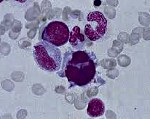
Миелодиспластический синдром
Описание
Миелодиспластический синдром (МДС) — группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз.
МДС сегодня является одной из самых сложных проблем гематологии. Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с целью облегчения симптомов.
МДС — это патология старшей возрастной группы. 80 % случаев МДС приходится на лица старше 60 лет. МДС в детском возрасте встречается крайне редко. В европейских странах среди лиц 50-69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения. Заболеваемость МДС в РФ в среднем составляет 3-4 случая на 100 тыс. Населения в год и увеличивается с возрастом.
Симптомы
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
Наиболее часто МДС манифестирует цитопениями, главным образом анемией.
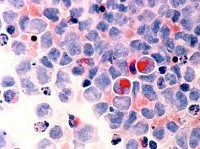
Миелодиспластический синдром
Диагностика
Диагностика МДС базируется исключительно на лабораторно-инструментальных методах, из которых ключевыми являются полный клинический анализ периферической крови, некоторые биохимические исследования и морфологический анализ аспиратов и биоптатов костного мозга.
Дифференциальная диагностика
Необходимо дифференцировать МДС от железа или B12- дефицитной анемии, постгеморрагической анемии, анемии при хронических заболеваниях и онкологии или связанной с хронической почечной недостаточностью, а также апластической анемией, пароксизмальной ночной гемоглобинурией. У 10 % пациентов имеются признаки инфекции, а у несколько меньшей доли пациентов болезнь проявляется кровотечениями.
Дифференциальная диагностика МДС также затруднена в силу множества состояний, имеющих общие с МДС клинико-лабораторные проявления.
Причины
Первичный (идиоптический) тип — 80-90 % случаев, вторичный(вследствие предшествующей химиотерапии и факторов) — 10-20 %. Большинство (80 %) случаев МДС являются первичными — идиопатическими или de novo (лат. — вновь появившийся, новый).
Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС. 10-20 % случаев МДС возникают вследствие предшествующей химиотерапии по поводу других новообразований. К препаратам, обладающим доказанной способностью повреждать геном с последующим развитием МДС, относятся алкилирующие агенты (циклофосфан), ингибиторы, топоизомеразы — противоопухолевые агенты растительного происхождения (топотекан, иринотекан и ), антрациклины (доксорубицин) и подофиллотоксины (этопозид). К МДС также могут приводить радиотерапия и контакт с токсическими материалами.
Факторы риска, первичный МДС:
• Контакт с токсинами (бензин, органические растворители, пестициды).
• Радиация.
• Курение.
• Врожденные и наследственные заболевания.
• Пожилой возраст.
Факторы риска, вторичный МДС:
Предшествующая химиотерапия онкологического заболевания или после ТКМ.
Прогноз
Прогноз: 5-летняя выживаемость при МДС не превышает 60 %. Трансформация в острый лейкоз ~30 % случаев.
Лечение
Не все пациенты с МДС нуждаются в терапии. Пациенты без анемического, геморрагического синдрома, инфекционных осложнений могут наблюдаться и не получать лечения (тактика «watch and wait»).
Выбор терапевтической тактики во многом определятся возрастом пациента, соматическим статусом, степенью риска по шкале IPSS, WPSS, наличием совместимого донора.
Можно выделить следующие направления терапии МДС:
• Сопроводительная терапия включает в себя переливание различных гемокомпонентов (эритроцитарной массы, тромбоконцентрата), терапию эритропоэтином, тромбопоэтином. У больных часто получающих гемотрансфузии развивается перегрузка организма железом. Железо обладает токсическим действием на различные ткани и органы, в первую очередь сердце, печень, поэтому такие пациенты должны получать препараты, связывающие железо — хелаторы (десферал, эксиджад).
• Иммуносупрессивная терапия наиболее эффективна у пациентов с гипоклеточным костным мозгом, нормальным кариотипом и наличием HLA-DR15. Леналидомид, обладающий иммуномодулирующим и антиангиогенным действием, показал свою эффективность у трети пациентов с рефрактерной анемией (согласно критериям ВОЗ) и низким риском (по IPSS), а также у больных с 5q- синдромом. Эффективность лечения в данном случае весьма высока; 95 % больных достигают цитогенетической ремиссии.
• Аллогенная трансплантация гемопоэтических стволовых клеток от совместимых доноров является методом выбора у пациентов с миелодиспластическим синдромом.
Пациентам с МДС моложе 65 лет, с хорошим соматическим статусом, при наличии HLA-совместимого донора показано проведение аллогенной трансплантации костного мозга, так как трансплантация является потенциально радикальным методом лечения МДС.
• Химиотерапия.
• Цитарабин, низкие дозы. Широко используются в России, да и во всей Европе, для лечения пациентов с МДС и ОМЛ, которым не подходит терапия методом ТКМ или применение интенсивной химиотерапии.
Мнения исследователей относительно целесообразности использования низкоинтенсивной терапии расходятся. Bowen D считает, что нет оснований рекомендовать её рутинное использование при МДС: было выполнено 3 рандомизированных крупных исследования (141 пац. ), которые показали, что применение низких доз цитарабина не увеличивает продолжительность жизни пациентов с МДС. Вместе с тем, в более позднем исследовании у пациентов с ОМЛ и МДС высокого риска было показано, что продолжительность жизни у больных, у которых применялся LDAC более, чем в 1 цикле, выше, чем при поддерживающей терапии.
Таким образом, необходимость в низкоинтенсивной терапии с доказанной эффективностью и лучшей переносимостью, чем LDAC, которая будет способствовать увеличению выживаемости пациентов с МДС высокого риска, остается актуальной.
• Высокодозная химиотерапия используется у больных с РАИБ с гипер- и нормоклеточным костным, при трансформации в ОМЛ. Пятилетняя выживаемость составляет около 18 %.
• Гипометилирующие препараты.
Новые многообещающие терапевтические подходы, широко обсуждающиеся в последнее время, по поводу которых проводятся многочисленные клинические исследования, возникли в результате глубокого изучения биологии МДС. Среди них следует отметить ингибиторы метилирования ДНК (5-азацитидин, децитабин) и иммуномодулятор — леналидомид. 5-азацитидин обладает двойным механизмом действия. Он встраивается не только в молекулу ДНК, но и в молекулу РНК. В процессе метилирования ДНК гипометилирующие агенты ковалентно связываются с ДНК-метилтрансферазой, что приводит к реактивации генов, после чего восстанавливается дифференцировка гемопоэтических клеток-предшественников и нормальное кроветворение. Азацитидин, встраиваясь в РНК молекулу, тем самым понижает её количество в клетках, что приводит к цитостатическому эффекту вне зависимости от клеточной фазы. На основании результатов исследования 3 фазы AZA-001 — международное, мультицентровое, контролируемое, в параллельных группах, в котором пациенты МДС высокого риска/ОМЛ (ВОЗ критерии) сравнивались со стандартным лечением (сопроводительная терапия, интенсивная химиотерапия, низкие дозы цитарабина), азацитидин был зарегистрирован, в том числе и в РФ, для лечения этих больных. Было показано, что азацитидин в 2,5 раза увеличивает общую выживаемость.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Миелодисплазия у детей – серьезная патология, характеризующаяся недоразвитием спинного мозга. Заболевание является врожденным и приводит к инвалидности. Имеет много форм, каждая из которых отличается особенностями развития и тяжестью проявления. В большинстве случаев требуется срочное хирургическое вмешательство.
Что такое миелодисплазия?

Понятие «миелодисплазия» включает в себя несколько заболеваний, связанных с опорно-двигательной системой. На данный момент выявлены и изучены следующие формы:
- спина бифида – характеризуется расщеплением позвоночника;
- спинномозговая грыжа – патология указывает на образование отверстия в твердых тканях позвоночника, сквозь который выпячиваются различные элементы спинного мозга;
- сирингомиелия – патология описывает образование в спинном мозге полостей, что влечет различные нарушения нервной системы;
- рахишизис – спинной мозг вытекает наружу, поскольку происходит расщепление позвоночника с образованием открытого канала;
- доброкачественные образования – это кисты в позвоночном столбе, которые часто поддаются хирургическому вмешательству без осложнений;
- остеофиты – образование участков из костной ткани по краям позвоночного столба.

Зачастую у больного проявляется сразу несколько патологий, что приводит к серьезным осложнениям в развитии. Ребенок вследствие патологий спинного мозга в большинстве случаев не имеет способности к самостоятельному перемещению.
Миелодисплазия в МКБ-10
Миелодисплазия в пояснично-крестцовом отделе позвоночника у детей диагностируется наиболее часто. Подобное объясняется генетическими причинами возникновения заболевания. Патология имеет код по МКБ D46.
Причины развития и факторы риска

Развитие представленной патологии происходит вследствие двух причин. Первая причина заключается в генетической мутации половых клеток родителей ребенка. Изменения происходят спонтанно или по факту наличия наследственной предрасположенности, что определяется в 25% случаев.
Вторая причина – воздействие негативных факторов на плод во время беременности матери.
Это проживание в регионах с плохой экологией, употребление наркотиков и алкоголя, курение, применение лекарственных препаратов, запрещенных во время беременности.
В группе риска находятся женщины старше 30 лет, у которых к тому же имеются хронические заболевания. Внимательно следует относиться к развитию плода и собственному состоянию при отягощенной беременности. В 70% случаев представленный синдром возникает при развитии авитаминоза, проникновении инфекции в утробу матери.

Клиническая картина и симптомы
Первые признаки развития патологии обнаруживают еще во время беременности женщины по факту проведения УЗИ. Заболевание негативно воздействует на формирование скелета, что выявляется на мониторе искривлением позвоночника. Подобное можно не заметить на ранних стадиях и после рождения ребенка, но уже до первого года жизни врачи могут заподозрить развитие патологии. Сомнения вызывают следующие симптомы:
- парезы и параличи мышц ног;
- отсутствие полноценной чувствительности конечностей, нередко ребенок не чувствует и прикосновения к животу, груди или спине;
- снижение тонуса и силы мышц конечностей;
- постепенное угасание рефлексов – проверяется в динамике;
- недержание мочи и кала, что не относится к малому возрасту ребенка;
- различные ортопедические проблемы – искривление позвоночного столба, ребенок косолапит при ходьбе;
- трофические заболевания – у ребенка на нижних конечностях образуются язвы, которые не заживают;
- нарушения походки;
- вследствие плохого кровообращения головного мозга отмечается задержка психического и моторного развития у малыша.

Примечательно, что патологии позвоночного столба могут иметь скрытую и открытую форму. Открытая форма заключается в образовании патологий, которые легко диагностируются, что значительно упрощает процесс лечения. Закрытые формы провоцируют существенные осложнения патологии, поскольку их тяжело выявить путем комплексной диагностики. Симптомы также могут не проявляться в течение длительного времени.
Методы диагностики

Миелодисплазия у детей выявляется еще на этапе вынашивания плода с помощью проведения ультразвукового исследования. Если этого не происходит и у ребенка обнаруживаются проблемы с опорно-двигательной системой уже после рождения, назначается комплексная диагностика. В данном случае выделяют следующие методы исследования:
- МРТ – основное обследование, которое дает возможность определить патологии позвоночного столба на любых стадиях своего развития. Именно МРТ назначается грудничку, у которого замечены проблемы с физическим развитием или диагностирована грыжа;
- рентген – второй по важности способ диагностики, который позволяет увидеть на снимке отверстия в костной ткани позвоночника. Аналогичным способом диагностируется сколиоз, кифоз и прочие патологии;
- нейросонография – метод схож со стандартным ультразвуковым исследованием. Только здесь идет обследование головного мозга, позволяющее исключить гидроцефалию. Гидроцефалия – это осложнение спинномозговой патологии, которую могут не выявить на момент явного развития «водянки» у ребенка;
- электронейромиография – метод задействует электрические импульсы, с помощью которых определяется степень поражения нервных и мышечных структур;
- УЗИ внутренних органов – требуется после определения патологии позвоночного столба. В данном случае выявляются осложнения, развитые по факту нарушения целостности позвоночника.

При скрытой форме миелодисплазии пояснично-крестцового отдела позвоночника у детей требуется регулярная комплексная диагностика – важно определить особенности развития осложнений, которые могут не проявляться в течение длительного времени.
Лечение миелодисплазии
Большинство из рассматриваемых патологий не поддается полноценному лечению. Ребенку можно сделать операцию, чтобы улучшить его состояние, но некоторые патологии являются неизлечимыми и в прошествии нескольких лет вновь доставляют страдания. Лечение малышей проводится комплексно.
Консервативное лечение

Консервативное лечение способно только облегчить страдания ребенка и немного сгладить проявление симптоматики. В комплекс лекарственных препаратов, которые назначаются больному для лечения, входят:
- нестероидные противовоспалительные средства – уменьшают частично воспаленную опухоль и болевой синдром;
- ингибиторы холиэстеразы – помогают в частичном восстановлении двигательной активности (улучшают функции периферических мышц);
- миорелаксанты – способны снизить тонус мышц, отчего малыш может двигать нижними конечностями при парезах;
- нейропротекторы – помогают в восстановлении участков нервной системы;
- витамины группы В – требуются для улучшения регенерации нервной ткани;
- спазмолитики – назначаются только при возникновении спазматических кишечных колик, что диагностируется не во всех разновидностях патологии;
- стимуляторы моторики пищеварительного тракта – назначаются при нарушении перистальтики кишечника.

Также используются немедикаментозные методы лечения, к которым относятся:
- лечебная физкультура – занятия проходят только под присмотром специалиста, который знает обо всех особенностях лечения детей с миелодисплазией. Предназначена для развития двигательных способностей ребенка, в особенности после оперативного вмешательства;
- массаж – специалист работает только с нижним отделом позвоночника и ногами, при необходимости и для профилактики массирует верхние части тела. Позволяет снять гипертонус мышц с последующей коррекцией позвоночных дисков и укрепления мышц;
- физиотерапия – включает несколько разновидностей электрического воздействия, действие которых направлено на улучшение микроциркуляции крови в пораженной области, на увеличение регенерации тканей и снятие воспаления. Здесь выделяют электрофорез, магнитотерапию, электростимуляцию, ультразвук и прочие методы.

Обязательно дети с миелодисплазией должны соблюдать диету. В рацион должно входить больше фруктов и овощей, чтобы перистальтика кишечника не давала сбои.
Хирургическое лечение
Оперативное вмешательство проводится только в клиниках, специализирующихся на нейрохирургии. В зависимости от особенностей патологии определяется степень сложности хирургической операции. Прибегают к оперативному лечению, если требуется:
- стабилизация позвоночного столба – оперируют только при наличии искривления позвоночника более 30 градусов;
- проведение пластики патологии – проводится в первые недели после рождения ребенка с целью максимально приблизить его к норме;
- микрохирургическое вмешательство – удаление кист и опухолей, которые могут в дальнейшем образовываться вновь;
- экстренное хирургическое вмешательство, к которому прибегают при возникновении разрыва спинномозговой оболочки в последней стадии грыж.

Хирургическое вмешательство существенно облегчает страдания ребенка. Но прибегать к ним следует только при наличии показаний. Родители детей должны понимать, что не всегда операции полностью восстанавливают двигательную активность. Требуется последующее консервативное лечение с постоянной диагностикой.
Прогноз и осложнения миелодисплазии
Определить в точности, что ждать от консервативного или хирургического лечения, невозможно. Можно спрогнозировать дальнейшее течение только в соответствии со степенью тяжести развившихся патологий. На качество жизни подросшего ребенка влияет своевременное лечение – родители сразу после обнаружения заболевания должны начать терапию.
Осложнения миелодисплазии пояснично-крестцового отдела заключаются в частичной или полной обездвиженности ребенка – развивается парез ног или всех конечностей. Помимо прочего, у малыша диагностируются гидроцефалия и прочие нарушения в работе головного мозга, а также патологии внутренних органов.
На сегодняшний день миелодисплазия лечится – частично или полностью. Важно только своевременно начинать проходить обследование и соблюдать предписания врача. При необходимости нужно прибегать к хирургическому вмешательству.
Источник